Immunità innata e morte cellulare nell’infiammazione polmonare cronica
Abstract
Le patologie infiammatorie croniche delle vie aeree, come la broncopneumopatia cronica ostruttiva (BPCO), sono caratterizzate da un quadro infiammatorio complesso, talvolta resistente al trattamento con farmaci steroidei e associato a rimodellamento delle vie aeree. Il fumo di sigaretta è uno dei principali fattori di rischio: induce stress ossidativo e danno tissutale, e altera la risposta immunitaria innata, generando infiammazione cronica e aumentando il rischio di infezione. Alterando i processi di risoluzione dell’infiammazione e promuovendo la morte cellulare, il fumo favorisce l’instaurarsi di infiammazione cronica in seguito a infezioni batteriche o virali.
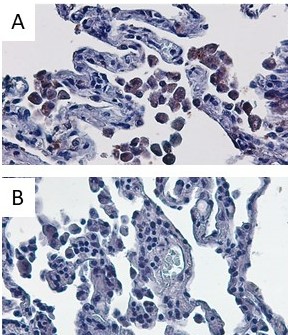
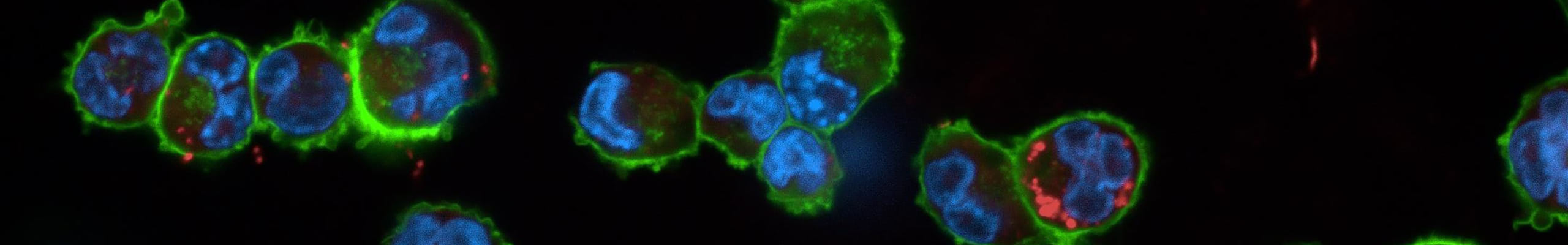
I macrofagi alveolari svolgono un ruolo chiave nell’orchestrare la risposta immunitaria innata nei confronti di agenti esterni e patogeni, garantendo una difesa efficace e attivando la risoluzione dell’infiammazione. La morte cellulare regolata (piroptosi, apoptosi, NETosi, etc) ha un ruolo chiave nella regolazione dell’infiammazione. Tuttavia, se da una parte assicura un’efficace risposta immunitaria, se non controllata può diventare fattore scatenante di risposte infiammatorie dannose per l’organismo.
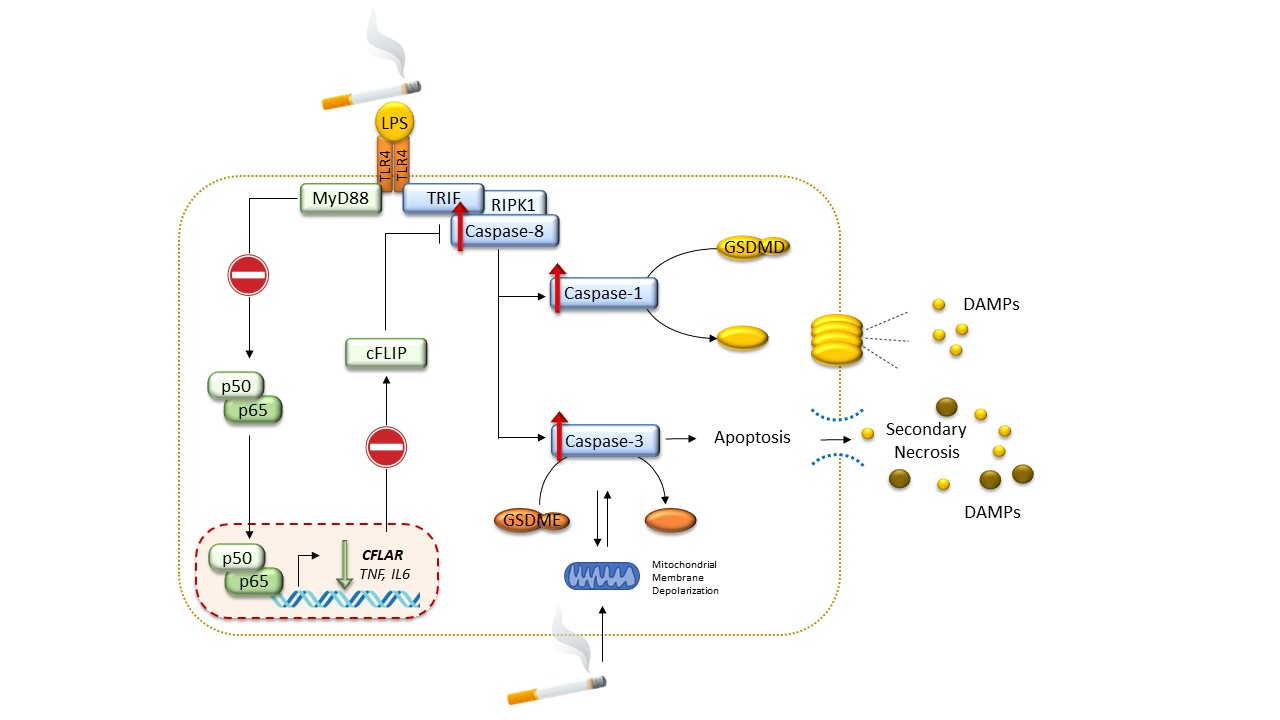
Gli inflammasomi sono complessi multiproteici composti da un recettore, una proteina adattatrice, nota come ASC, e la pro-caspasi-1. L’attivazione dell’inflammasoma promuove l’attivazione autocatalitica della caspasi-1, che a sua volta attiva pro-IL-1β, pro-IL-18 e gasdermin D (GSDMD). In seguito ad attivazione, GSDMD forma pori sulle membrane cellulari, consentendo la secrezione non convenzionale di proteine intracellulari e aumentando la permeabilità portando infine a una morte cellulare litica e pro-infiammatoria nota come piroptosi.
Il nostro studio si concentra sul ruolo degli inflammasomi e della morte cellulare: (i) nella patogenesi delle malattie polmonari croniche associate a fumo di sigaretta; (ii) nella risposta a infezioni virali.
Ipotizziamo che l’attivazione di gasdermine nelle cellule mieloidi polmonari, contribuendo al rilascio di damage-associated molecular pattern (DAMPs) ed morte cellulare, contribuisca all’infiammazione neutrofilica steroido-resistente e promuova l’attivazione di pathway pro-fibrotici contribuendo al rimodellamento delle vie aeree.
Pipeline
-
CLINICAL
NEED -
DISEASES
ANALYSIS - DISCOVERY
-
PRECLINICAL
VALIDATION -
PRECLINICAL
DEVELOPMENT -
CLINICAL
STUDIES
Responsabile Progetto
Contatto
Team di progetto:
Maria Rita Giuffrè
Agnese La Mensa, PhD
Lara Di Leonardo
Salvatore Caruccio
Aree terapeutiche:
Prodotto:
Farmaci – Biomarcatori
Collaborazioni:
- IRCCS ISMETT, Palermo, Italia;
- Istituto di Farmacologia Traslazionale (IFT)-CNR, Palermo, Italia;
- Istituto per la Ricerca e l’Innovazione Biomedica (IRIB) – CNR, Palermo, Italia;
- Dipartimento di Biomedicina, Neuroscienze e Diagnostica avanzata, Università Degli Studi di Palermo; Palermo, Italia;
- Azienda di Rilievo Nazionale ed Alta Specializzazione Ospedali (A.R.N.A.S) “Civico Di Cristina Benfratelli”, Palermo, Italia;
- University Medical Center Groningen (The Netherlands).
Scarica il pdf del progetto