Meccanismi molecolari delle malattie da misfolding proteico
Abstract
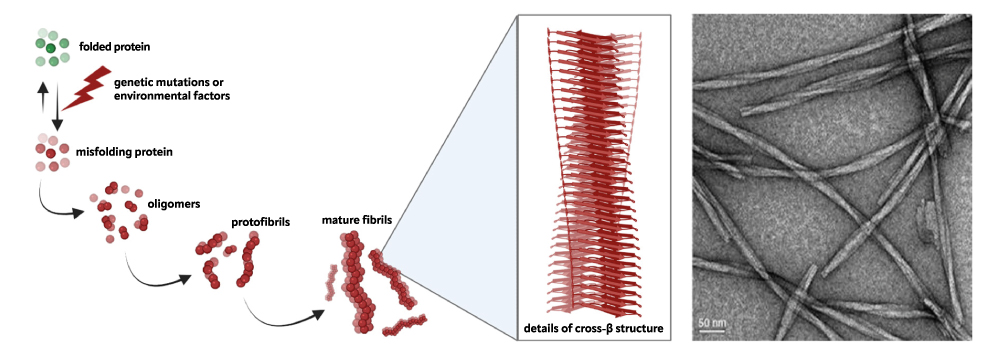
Le malattie neurodegenerative costituiscono una famiglia eterogenea di patologie, ciascuna caratterizzata dalla perdita di neuroni in una specifica regione del sistema nervoso e conseguente sintomi clinici specifici. Tuttavia, queste patologie sembrano tutte condividere lo stesso meccanismo molecolare che comporta il progressivo accumulo di aggregati proteici nel tessuto nervoso, causando tossicità e successiva morte cellulare. Nello specifico, una mutazione o un evento stocastico possono destabilizzare una particolare proteina, unica per ogni condizione neurodegenerativa. Questa proteina perde il suo corretto folding e si aggrega in strutture amiloidi insolubili, contro le quali i normali sistemi di controllo della cellula si rivelano inefficaci. Uno studio dettagliato di questo meccanismo patologico è quindi cruciale per esplorare potenziali strategie terapeutiche volte a rallentare o, idealmente, inibire la formazione di questi aggregati proteici.
In questo contesto, la nostra ricerca è focalizzata sulla comprensione dei meccanismi molecolari che portano all’aggregazione proteica, e sulla caratterizzazione di specifiche interazioni proteina-ligando. Queste informazioni sono alla base della progettazione di molecole antiaggreganti in grado di colpire un sito specifico, limitando gli effetti collaterali.
Il nostro attuale lavoro è finalizzato allo studio dei meccanismi di aggregazione patologica delle proteine Atassina-3 e TDP-43, coinvolte rispettivamente nell’Atassia Spinocerebellare di tipo 3 (SCA3) e nella Sclerosi Laterale Amiotrofica (SLA). L’approccio biofisico prevede l’uso della spettroscopia di risonanza magnetica nucleare (NMR), della spettroscopia di fluorescenza, della calorimetria e delle tecniche di interferometria. Inoltre, abbiamo accesso a tecniche di biologia strutturale standard quali lo scattering a raggi X a basso angolo (SAXS), per bassa risoluzione, e la cristallografia a raggi X per risoluzione atomica. Utilizziamo anche tecniche di microscopia avanzate (ad esempio microscopia elettronica a trasmissione e microscopia a forza atomica) per studi morfologici degli aggregati proteici post-trattamento.
Impatto
I progressi compiuti nella biomedicina hanno allungato la durata della nostra vita. Tuttavia, questa longevità prolungata ha portato con sé un forte aumento del verificarsi di condizioni di salute debilitanti legate all’invecchiamento. Ciò ha reso le malattie neurodegenerative un peso quotidiano per milioni di pazienti sofferenti e le loro famiglie, nonché una grande emergenza sanitaria per i governi. Sfortunatamente, i trattamenti attuali sono, nel migliore dei casi, palliativi e scarsamente efficaci, riflettendo una comprensione limitata del processo molecolare della maggior parte di queste malattie. La mancanza di una profonda comprensione dei fondamenti molecolari delle malattie neurodegenerative porta a terapie inefficienti e non specifiche. La nostra ricerca approfondisce sia la biologia strutturale che quella cellulare, svelando informazioni cruciali sui meccanismi delle malattie neurodegenerative. Le conoscenze acquisite aiuteranno nella progettazione di terapie specifiche e, allo stesso tempo, forniranno importanti indizi riguardo al fenomeno fondamentale del ripiegamento e dell’aggregazione delle proteine. Gli studi biofisici, insieme alle analisi strutturali, sono fondamentali per definire meglio le basi molecolari del meccanismo patologico di queste proteine, altamente soggette ad aggregazione, utilizzando test in vitro con proteine ricombinanti. Le informazioni ottenute potranno essere utilizzate sia per la progettazione di composti antiaggreganti più specifici ed efficaci in grado di interferire con l’aggregazione patologica, sia per la validazione di modelli in vitro innovativi che possano mimare la complessità dei sistemi in vivo.
Pipeline
-
CLINICAL
NEED -
DISEASES
ANALYSIS - DISCOVERY
-
PRECLINICAL
VALIDATION -
PRECLINICAL
DEVELOPMENT -
CLINICAL
STUDIES
Principal Investigator
Contatto
Team di progetto:
Maria Agnese Morando, PhD
Aree terapeutiche:
Prodotto:
Farmaci chimici e biologici
Collaborazioni:
- UK Dementia Research Institute (UK DRI) – King’s College London, Londra, Regno Unito
- Dipartimento di Fisica e Chimica (DiFC) – Università degli Studi di Palermo, Palermo, Italia
- Institute of Nanotechnology (CNR Nanotec) – CNR, Lecce, Italia
- i3S Institute for Research and Innovation in Health, Porto, Portogallo
