Nuove piattaforme per la rigenerazione di organi a partire da cellule staminali/progenitori
Abstract
Le insufficienze d’organo destano molta preoccupazione poiché la richiesta di organi trapiantabili supera di gran lunga la disponibilità di organi donati.
Numerosi tessuti sono stati ingegnerizzati in vitro con buoni risultati, ma tra questi, solo quelli semplici o con basse richieste metaboliche, hanno raggiunto la pratica clinica.
La vascolarizzazione di tessuti solidi di grandi dimensioni, o di organi con esigenze metaboliche più elevate, rimane ancora una sfida. Nel tentativo di superare questa limitazione, abbiamo messo a punto un modello di ingegneria tissutale vascolarizzato in vivo, in cui cellule/tessuti specifici vengono impiantati in un linfonodo (LN). Il LN, che è un organo linfoide secondario che funge da filtro per particelle estranee e cellule tumorali, è in grado di espandersi rapidamente e di accogliere in questo modo organi in via di sviluppo, ed ha anche un accesso vascolare diretto, entrambi requisiti indispensabili per lo sviluppo di organi funzionali.
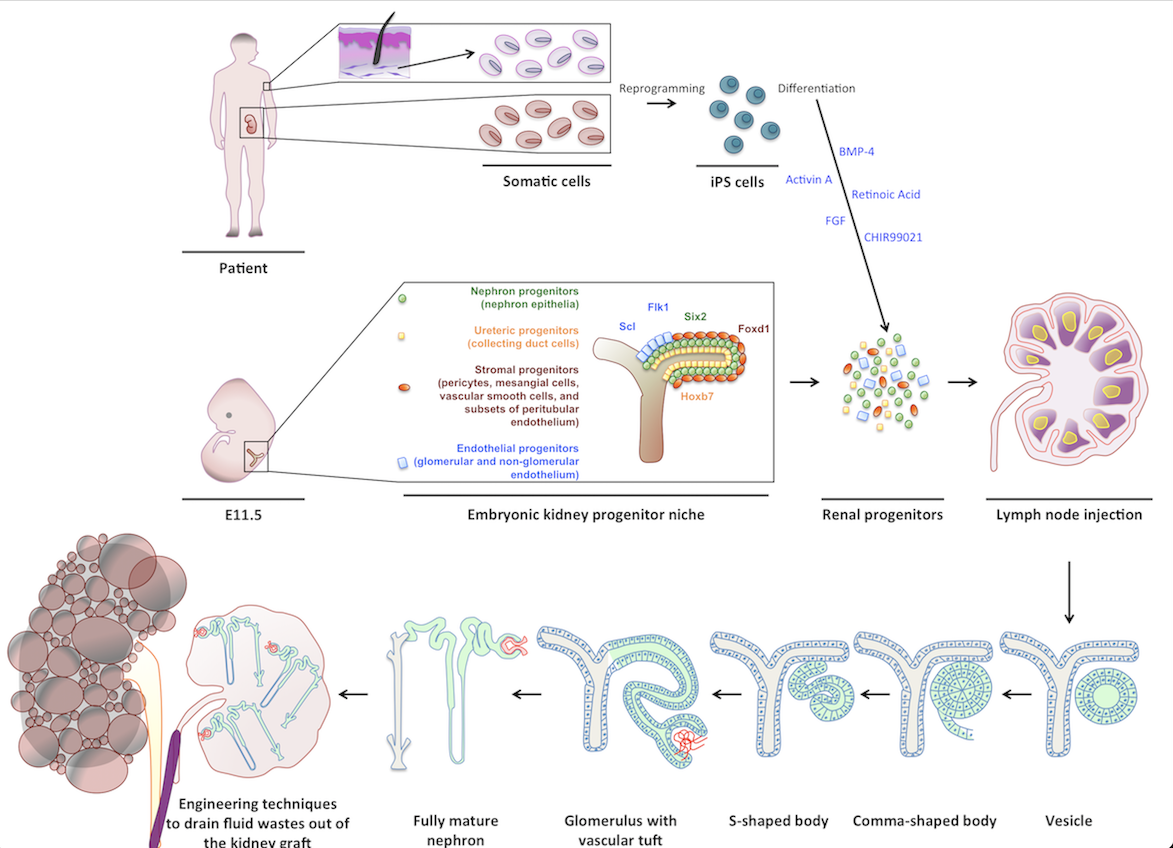
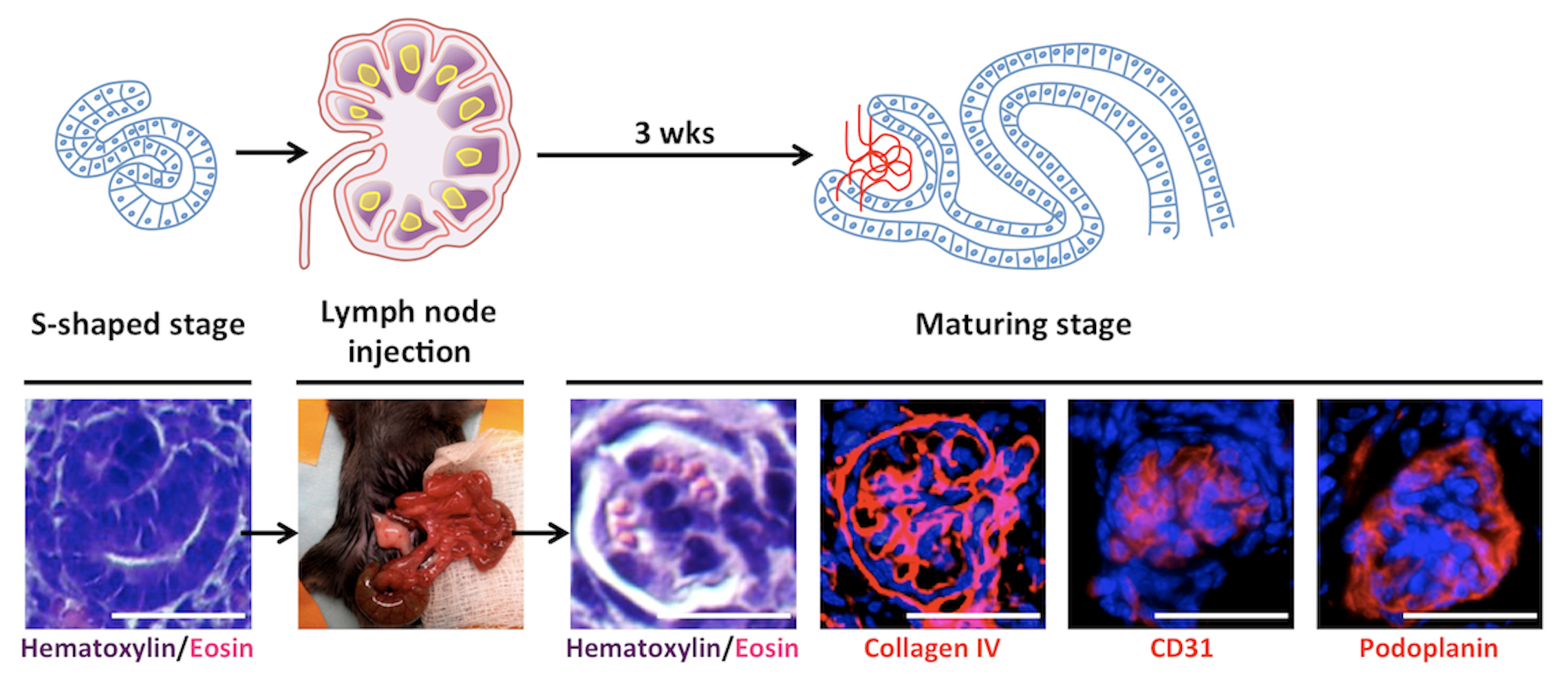
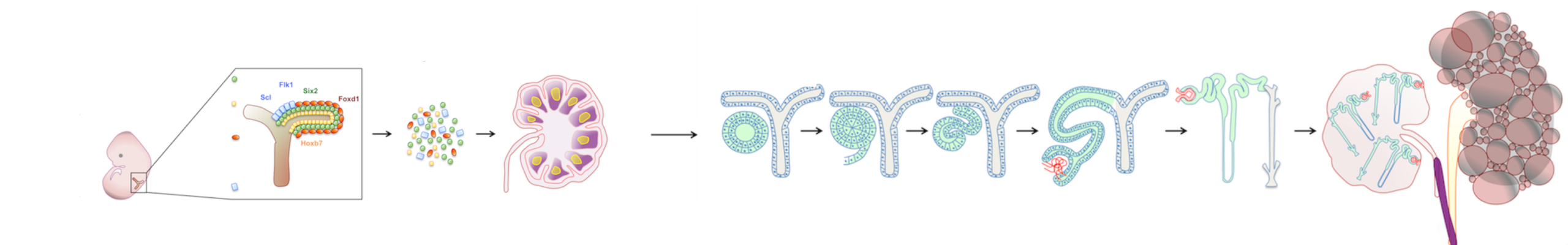
Inizialmente, ho studiato la capacità del LN di supportare la maturazione di diversi tessuti embrionali. Successivamente, il mio interesse si è concentrato sui tessuti renali. Tra tutti gli organi, i reni sono quelli più richiesti per i trapianti. Gli attuali approcci sperimentali, compreso il ripopolamento di scaffold renali decellularizzati, non sono riusciti a generare tessuti renali maturi e perfusi in grado di produrre urina e/o svolgere funzioni endocrine. La mia ricerca ha dimostrato che quando trapiantati in un LN, rudimenti renali di topo o umani maturano acquisendo funzioni escretorie, omeostatiche ed endocrine. Il mio studio ha anche suggerito la possibilità di utilizzare il LN come piattaforma per testare il potenziale di nuove fonti cellulari da utilizzare per l’ingegneria dei tessuti renali, incluse le cellule staminali pluripotenti indotte umane differenziate verso un destino renale in vitro. Ho anche studiato i meccanismi cellulari/molecolari che guidano l’organogenesi renale nel LN e nell’omento, un altro sito linfoide. I miei dati indicano che la via di trasduzione del segnale innescata da LTbR nelle cellule linfoidi stromali è fondamentale per l’angiogenesi dei tessuti renali trapiantati in questi siti.
Similmente ai LN, i cluster linfoidi associati al grasso addominale (FALC) possono supportare la rigenerazione degli organi. In particolare, il nostro lavoro ha dimostrato la possibilità di formare, sia nei LN che nei FALC, fegati ectopici funzionali in grado di guarire animali tirosinemici dall’insufficienza epatica.
Complessivamente, questi studi hanno portato al rilascio di due brevetti: “Lymph node as a site for transplantation, organogenesis and function for multiple tissues and organs” (E. Lagasse, inventore; Numero di pubblicazione: US20160058794; Data di pubblicazione: 3 marzo 2016) e “Fat-associated lymphoid clusters as sites for transplantation, organogenesis and function for multiple tissues” (E. Lagasse, inventore; Numero di pubblicazione: US20190374583; Data di pubblicazione: 12 dicembre 2019). Questi lavori hanno portato anche alla creazione di LyGenesis Inc, uno spin-out dell’Università di Pittsburgh (E. Lagasse, CSO; M. Hufford, CEO; P. A. Fontes, CMO) per cui ho prestato servizio come volontario. Il programma preclinico principale di LyGenesis si concentra sulla rigenerazione del fegato utilizzando i LN dei pazienti per ripristinare le funzioni epatiche. L’iniezione di cellule epatiche in LN di topi tirosinemici ha dato luogo a mini-fegati surrogati che hanno supplito alle funzioni dei fegati nativi malati. Anche i nostri studi preclinici sui suini sono stati incoraggianti e, nel periodo in cui supportavo LyGenesis (luglio 2019-luglio 2020), l’azienda stava completando uno studio preclinico sui cani, necessario per avviare lo studio clinico sull’uomo. In LyGenesis, ho contribuito ad isolare epatociti canini conformi alle buone pratiche di fabbricazione (GMP). LyGenesis ha ricevuto l’autorizzazione da parte dell’FDA per iniziare lo studio di Fase 2a basato sul trapianto di epatociti allogenici in LN periduodenali di pazienti con malattia epatica allo stadio terminale nel dicembre 2020, e sta attualmente reclutando pazienti (identificatore ClinicalTrials.gov: NCT04496479).
Le attività di LyGenesis includono anche la rigenerazione del timo all’interno del LN. A questo proposito, le mie ricerche hanno stabilito una relazione tra la quantità di timo trapiantato nei LN di topi atimici e la quantità di cellule T di nuova formazione in questi topi. I miei risultati hanno anche suggerito che i topi di sesso maschile producono meno cellule T dopo il trapianto di timo rispetto ai topi di sesso femminile. È importante sottolineare che basse quantità di timo in topi anziani wild type di sesso femminile producono un ringiovanimento delle cellule T native, aumentando le percentuali di cellule T CD4+ naïve a scapito delle cellule T CD4+ effettrici/di memoria. Questo studio ha portato al rilascio del brevetto: “Autologous thymic tissue transplantation” (E. Lagasse, inventore; Numero di pubblicazione: US20220152114A1; Data di pubblicazione: 19 maggio 2022).
Pipeline
-
CLINICAL
NEED -
DISEASES
ANALYSIS - DISCOVERY
-
PRECLINICAL
VALIDATION -
PRECLINICAL
DEVELOPMENT -
CLINICAL
STUDIES
Principal Investigator
Contatto
Aree terapeutiche:
Prodotto:
Organi artificiali
Collaborazioni:
University of Pittsburgh, Department of Pathology. Pittsburgh, Pennsylvania, USA.
McGowan Institute for Regenerative Medicine. Pittsburgh, Pennsylvania, USA.
Mayo Clinic. Rochester, Minnesota, USA
Saint Barnabas Medical Center. Livingston, New Jersey, USA
Scarica il pdf del progetto