Nuove piattaforme per la rigenerazione di organi a partire da cellule staminali/progenitori
Abstract
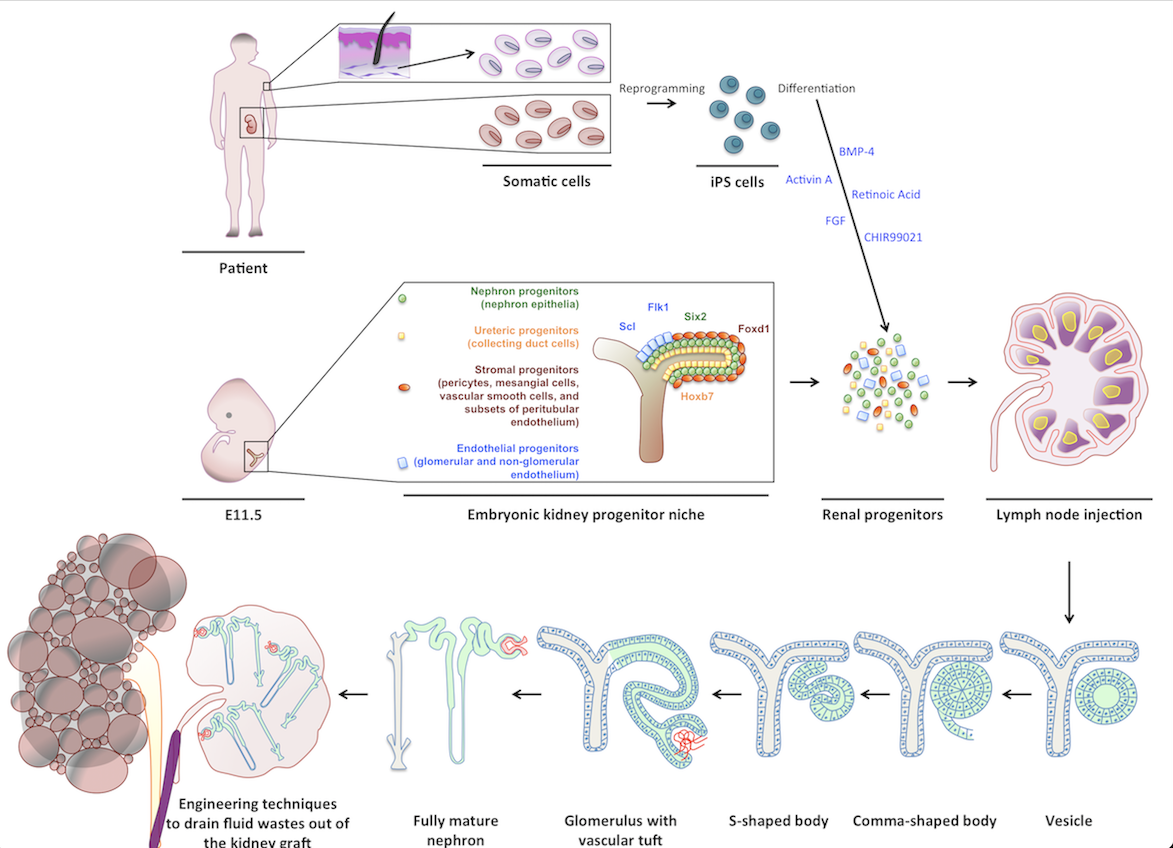
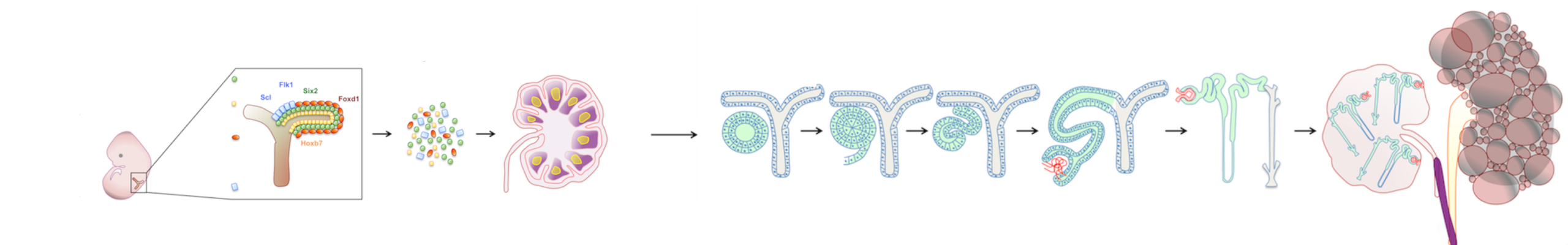
L’insufficienza d’organo irreversibile è una sfida globale, poiché la richiesta di organi trapiantabili supera ampiamente l’offerta. Sebbene diversi tessuti siano stati ingegnerizzati in vitro, i successi clinici riguardano quasi esclusivamente tessuti sottili o a basso consumo metabolico: la vascolarizzazione di organi più grandi rimane infatti un ostacolo significativo. Per superare questa barriera, abbiamo sviluppato un modello di ingegneria tissutale in vivo impiantando cellule o tessuti nei linfonodi (LN). I LN si espandono rapidamente per accogliere cellule aggiuntive e dispongono di un accesso vascolare immediato, caratteristiche ideali per sostenere la formazione di organi funzionali.
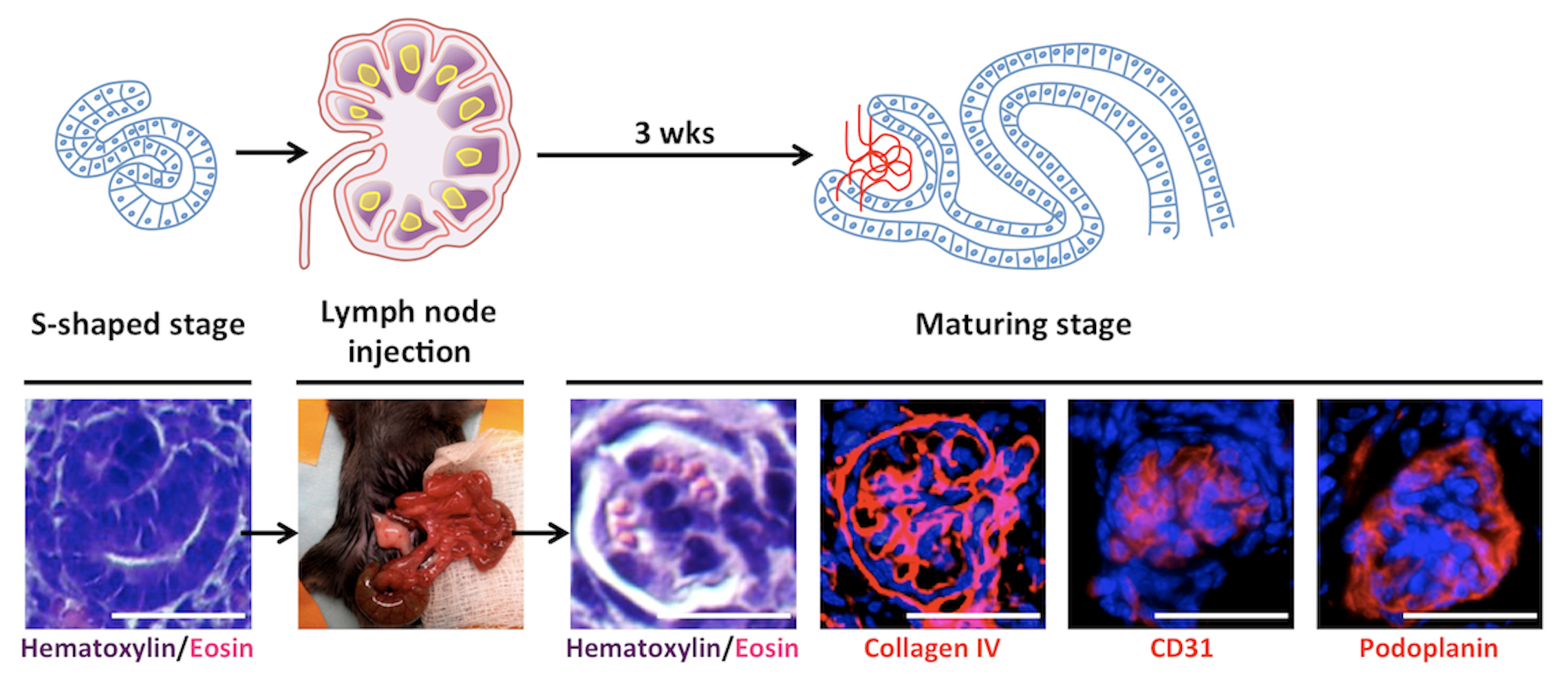
Inizialmente ho valutato la capacità dei LN di supportare la maturazione di diversi tessuti embrionali, indirizzando poi il mio interesse verso l’ingegneria del rene. I reni sono l’organo più richiesto per trapianti e le strategie attuali—come la ripopolazione di scaffold decellularizzati—non hanno ancora prodotto tessuti renali maturi, perfusi e funzionalmente competenti. Al contrario, rudimenti renali murini e umani trapiantati nei LN maturano in strutture dotate di funzioni escretorie, omeostatiche ed endocrine. I LN supportano inoltre l’attecchimento e la maturazione sia di progenitori nefronici murini sia di cellule renali umane derivate da iPSC. Studi meccanicistici hanno mostrato che il microambiente stromale linfatico e il segnale mediato dal Lymphotoxin beta receptor sono essenziali per l’angiogenesi dei tessuti renali trapiantati, sia nei LN sia nell’omento.
Abbiamo inoltre dimostrato che i cluster linfoidi associati al tessuto adiposo (FALC) possono sostenere l’organogenesi, consentendo la formazione di fegati ectopici funzionali capaci di salvare animali tirosinemici.
Questi studi hanno portato a due brevetti che descrivono LN e FALC come sedi per l’organogenesi e alla fondazione di LyGenesis Inc., spin-off dell’Università di Pittsburgh dedicato allo sviluppo di terapie rigenerative basate sui LN. Nel mio periodo di volontariato presso l’azienda, ho contribuito all’isolamento di epatociti canini di qualità GMP mentre LyGenesis avanzava verso la sperimentazione clinica.
Nel 2020 l’azienda ha ottenuto l’autorizzazione FDA per uno studio di Fase 2a che prevede il trapianto di epatociti allogenici nei LN periduodenali in pazienti con malattia epatica terminale (NCT04496479). Dopo il trattamento del primo paziente, il Data and Safety Monitoring Board ha approvato, nel marzo 2025, la prosecuzione dello studio e l’escalation della dose.
Oltre alla sua piattaforma renale, che rimane allo stadio preclinico in vivo, l’azienda sta sviluppando anche una piattaforma per il timo ectopico, anch’essa a livello preclinico, a cui ho partecipato attivamente. I miei studi non pubblicati hanno mostrato una correlazione tra la quantità di tessuto timico trapiantato nei LN di topi atimici e la produzione di nuove cellule T, oltre a evidenziare differenze sesso-specifiche nella capacità rigenerativa e un ringiovanimento della funzione T nelle femmine anziane. Questo lavoro ha portato a un ulteriore brevetto sul trapianto di tessuto timico.
Pipeline
-
CLINICAL
NEED -
DISEASES
ANALYSIS - DISCOVERY
-
PRECLINICAL
VALIDATION -
PRECLINICAL
DEVELOPMENT -
CLINICAL
STUDIES
Principal Investigator
Contatto
Aree terapeutiche:
Prodotto:
Organi artificiali
Collaborazioni:
University of Pittsburgh, Department of Pathology. Pittsburgh, Pennsylvania, USA.
McGowan Institute for Regenerative Medicine. Pittsburgh, Pennsylvania, USA.
Mayo Clinic. Rochester, Minnesota, USA
Saint Barnabas Medical Center. Livingston, New Jersey, USA
Scarica il pdf del progetto