iRhom2: un nuovo target terapeutico in osteoartrosi?
Abstract
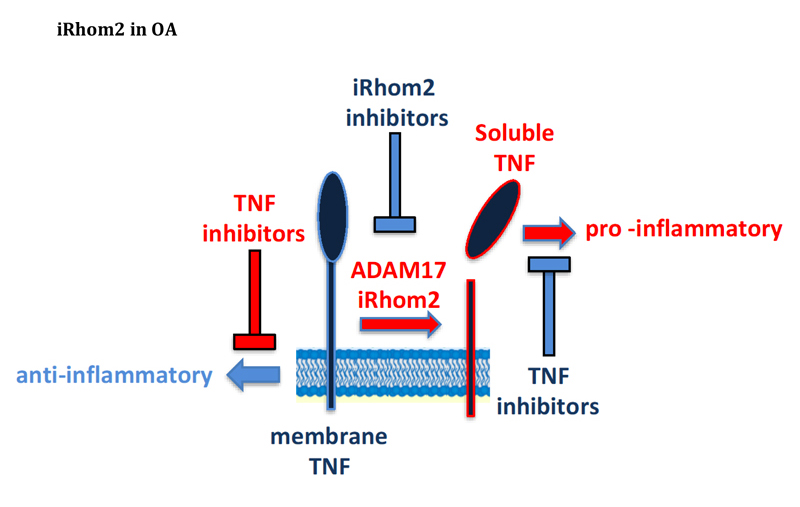
L’osteoartrosi (OA) è una patologia debilitante che causa dolore articolare. Dal punto di vista molecolare, l’OA è caratterizzata da degradazione della cartilagine articolare a causa dell’attività aberrante di due classi di metalloproteasi, le MMPs e ADAMTSs. II recettore endocitico LRP1 controlla il turnover di queste proteasi, per cui la sua inattivazione a seguito di “shedding” proteolitico contribuisce alla progressione della malattia. La citochina proinfiammatoria TNF svolge un ruolo critico nell’OA, in quanto induce un aumento dell’espressione delle metalloproteasi. Analogamente a LRP-1, il TNF viene processato, e quindi attivato, da ADAM17. È chiaro come l’inibizione di ADAM17 possa bloccare la progressione dell’OA prevenendo lo spegnimento di LRP-1 e l’attivazione di TNF. Tuttavia, ADAM17 rilascia più di 80 proteine diverse e, di conseguenza, la sua inibizione completa porta alla deregolazione di tutte queste proteine e alla potenziale insorgenza di gravi effetti collaterali. iRhom1 e iRhom2 sono regolatori essenziali di ADAM17, in quanto guidano la sua maturazione e attività proteolitica. Usando “unbiased proteomics” abbiamo scoperto che il rilascio di TNF e LRP-1 è mediato da ADAM17 solo quando la proteasi è in complesso con iRhom2, ma non iRhom1. Pertanto, l’inibizione farmacologica di iRhom2 può essere protettiva nell’OA, con bassi rischi di effetti collaterali.
Impatto:
Il progetto proposto si prefigge di esaminare il ruolo di iRhom2 nel contesto dell’OA. iRhom2 guida il traffico molecolare e la maturazione di ADAM17, una proteasi con un ruolo cruciale nello sviluppo e nell’infiammazione. Sebbene basato su solidi dati proteomici, il progetto è altamente innovativo. Innanzitutto, il progetto mira allo sviluppo di una nuova terapia per l’OA. Infatti, questo studio prevede di generare una molecola che sia in grado di bloccare la funzione di iRhom2 e quindi il rilascio di TNF e l’inattivazione di LRP-1. Inoltre, il ruolo negativo di TNF e iRhom2 nella patogenesi di malattie infiammatorie e neurodegenerative, come l’artrite reumatoide e l’Alzheimer, è già stato dimostrato, e l’inibitore che vogliamo sviluppare può trovare applicazioni nella terapia di queste malattie. Recentemente è emerso che iRhom2 e il suo omologo iRhom1 possono dirigere l’attività ADAM17 verso substrati specifici, ma questo campo di ricerca è ancora agli inizi. Il nostro studio prevede un’analisi completa di quelle proteine che vengono processate da ADAM17, in modo iRhom1- o iRhom2-dipendente. Pertanto, questo studio fornirà ulteriori approfondimenti sulla biologia degli iRhom, rivelando nuove proprietà funzionali e strutturali di queste proteine e il meccanismo con cui regolano la selettività di ADAM17.
Pipeline
-
CLINICAL
NEED -
DISEASES
ANALYSIS - DISCOVERY
-
PRECLINICAL
VALIDATION -
PRECLINICAL
DEVELOPMENT -
CLINICAL
STUDIES
Principal Investigator
Contatto
Aree terapeutiche:
Prodotto:
Farmaci chimici e biologici
Collaborazioni:
- Institute of Aging and Chronic Diseases, University of Liverpool, Liverpool, Regno Unito
- Pharmacy Department, Università di Pisa, Pisa, Italia
- German Center for Neurodegenerative Diseases (DZNE), Monaco, Germania
Scarica il pdf del progetto
